对甲苯磺酰胺注射液(PTS)对裸鼠移植型肺癌的抗肿瘤作用
前言
最近一项大规模前瞻性研究表明,恶性肿瘤是我国成人死亡的主要原因之一[1]。在过去的30年里,我国肺癌的死亡率增加了464.84%。自2008年,肺癌的死亡率已经超过肝癌,成为我国致死率最高的恶性肿瘤[2]。虽然早期肺癌行手术治疗有较好的预后[3],但因其多无临床症状,较难诊断,导致多数肺癌患者失去最佳的手术治疗机会。因此,多数肺癌患者预后不良,5年生存率约5-10%[4]。晚期中央型支气管肺癌多采取采用激光、射频消融、冷冻或局部放射等姑息治疗,以便快速解除气道阻塞 [5-7]。但上述方法均需要较复杂的设备和技术,对操作者的要求较高,从而限制了其临床应用。无水乙醇常用于治疗实体肿瘤特别是肝脏肿瘤,具有一定的治疗作用[8-12]。但治疗效果并不令人满意。由于无水乙醇对肿瘤的破坏作用不完全,肿瘤较易复发[13, 14];此外,为使无水乙醇在肿瘤组织产生足够的坏死范围,多需要较大注射剂量,加之其渗透性较强,易于渗透到周围正常组织,可引起邻近组织损伤出血、酒精中毒、疼痛、发热等多种并发症[15-19]。因此,采用无水乙醇治疗实体肿瘤有较大局限,并未广泛开展。
对甲苯磺酰胺注射液(Para-toluenesulfonamide,PTS)是一种以对甲苯磺酰胺为主要成分的新型抗肿瘤药物,为透明脂溶性溶液。其活性成分对甲苯磺酰胺的浓度为330mg/ml,通过瘤内和瘤周局部注射的方法给药。早期基础研究方面,在体和离体水平均已证实PTS能有效抑制肝癌、肺癌等肿瘤的生长[20-22]。在临床研究方面,前期的研究也验证了PTS与其他药物联用的安全性[23]。并且有多项关于PTS在乳腺癌、肝癌、皮肤癌等多种肿瘤的Ⅱ期临床试验正在进行,均证明其疗效显著[24-27]。在一项晚期周围型肺癌Ⅱ期临床试验中[28],化疗药物吉西他滨顺铂联用加PTS瘤内局部注射,其安全性和疗效已得到证实。因此,PTS有着广阔的应用前景,肺部肿瘤也不例外。然而,PTS在抗肺部肿瘤机制方面的基础研究有限。因此,本文主要从在体和离体实验两方面,观察PTS抗肺部肿瘤的疗效,并探讨其相关机制。
实验方法
肿瘤细胞系及培养
人非小细胞肺癌细胞系H460(中科院上海细胞库,中国)采用含10%胎牛血清,青链双抗的DMEM培养基(均购自Gibco, 美国)培养,放入含5% CO2的37度恒温培养箱(Thermo,美国)中。取对数生长期的细胞进行实验。.
在体实验
实验设计
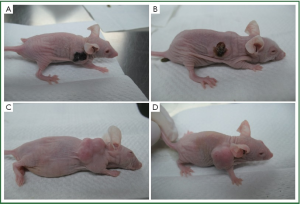
雌性裸鼠Balb/c(nu/nu)40只,周龄4周,体质量18-22g,购自广东省实验动物中心(广州,中国);整个实验裸鼠均放置于12小时昼夜交替的SPF级环境下生长。动物实验方案已通过医院伦理委员会批准。一周后将0.2mL(5×106)H460细胞悬液注射于裸鼠背部皮下。2周后,肿瘤生长至0.5 mL (长宽1.0 cm ×1.0 cm)。PTS(北京健达康新药开发有限公司,中国)原液高度粘稠,直接注射较困难。实验根据其肺部肿瘤Ⅱ、Ⅲ临床试验方案,在PTS处理组,PTS与无水乙醇按照7:3比例混合,以利于注射。将成瘤的裸鼠随机分为4组, PTS组、无水乙醇组、30%乙醇溶剂对照组、生理盐水对照组,每组10只。根据PTS量效关系研究[29],各组采用微量注射器,在瘤上3个不同点分别进行注射,总剂量为50ul/次,1次/4天,实验结束前共治疗4次。
肿瘤体积测定及组织学分析
用精密游标卡尺测量肿瘤的长径(a)和短径(b),按体积公式V=ab2/2计算肿瘤的体积[30],进行比较。各组每四天测量一次肿瘤体积,绘制肿瘤体积曲线。
各组裸鼠于末次注射后24h处死取瘤并称重,随机从各组取肿瘤组织进行组织学分析。标本用10%多聚甲醛溶液固定,石蜡包埋, 制片, HE染色, 光镜下观察肿瘤组织的病理变化,并用Image Pro Plus软件计算各组肿瘤的坏死面积。
离体实验
注射剂的稀释
PTS难溶于DMEM培养基。因DMSO常用于溶解实验中的难溶于水的物质,实验选用DMSO稀释PTS以帮助其溶解于培养基。PTS稀释至1/50时,需用含2%DMSO的DMEM稀释。而无水乙醇可直接溶解于培养基。选用DMEM培养基和含2%DMSO的培养基做为对照组。PTS和无水乙醇均按照此方法进行倍比稀释,进行细胞坏死、活性及细胞膜通透性的检测。
细胞的坏死检测
采用细胞凋亡坏死试剂盒(碧云天,中国)(Hoecst33342及PI双染),检测PTS对肺部肿瘤的致坏死作用。将H460细胞(5×105/孔)接种入6孔板中,生长至80%密度。用含1%FBS血清培养基静置12h后,分别加入倍比稀释的PTS和乙醇(浓度为1/50、1/100、1/150、1/200)作用2h,用4℃的PBS洗涤一次,每孔加入1mL磷酸盐缓冲液,依次加入Hoecst33342(10ng/mL)和PI(10ng/mL)各5uL。混匀,4℃孵育30分钟,加入PBS洗涤2次后,在荧光显微镜(莱卡,德国)下观察每个稀释倍数随机选5个视野,用Image Pro Plus统计坏死细胞数和细胞总数(每个视野下100个细胞,总数超过500个细胞),计算坏死率(%)。
细胞活性检测
选用CCK-8试剂盒(Dojindo Molecular Technologies, 日本)检测[31],成分包涵WST-8是一种水溶性四唑盐,可以与线粒体内的琥珀酸脱氢酶反应,从而反映活细胞的数量。CCK-8的敏感性优于同类四唑盐如MTT、XTT及MTX。将H460细胞以8×103/孔接种于96孔板中,在含1%FBS DMEM培养基静置12h后,加入不同稀释浓度(1/10,1/50,1/100,1/200)的PTS和无水乙醇,分别作用2h、6h、24h。对照组只加入含2%DMSO的DMEM或DMEM到达时间点后吸出培养基,每孔加入含110uL含10uLCCK-8试剂的培养基。反应1-2h后测定490nm的吸光度(OD值),计算各浓度对细胞活性率,每个浓度重复3个孔,实验重复2次。肿瘤细胞的存活率(%)=(实验组OD值-空白组OD值/对照组OD值-空白组OD值)×100%。将各浓度PTS和无水乙醇组的存活率进行统计学分析。
细胞膜通透性检测
采用乳酸脱氢酶(LDH)释放(碧云天,中国)试验,检测PTS对H460细胞细胞膜通透性的影响[32]。基于细胞CCK-8的结果,选取PTS的浓度为1/200、1/400、1/800、1/1600观察细胞的LDH释放。因为H460细胞在此浓度范围时,细胞活性>90%。在此浓度以下观察到的LDH释放是细胞膜通透性变化而释放出的,而不是因为细胞膜溶解,细胞死亡造成的[33]。因此我们选取将H460细胞以8×103/孔接种于96孔板中,在含1%DMEM培养基静置12h后,分别加入不同稀释浓度的PTS和无水乙醇(浓度为1/200、1/400、1/800、1/1600),分别作用2h、6h。到达检测时间点,400g离心5分钟,分别吸取上清120uL,至新的96孔板中,每孔加入60 uL的LDH工作液,混匀,室温避光孵育30分钟,在490nm测定各孔OD值,计算各组LDH释放率。LDH释放率(%)= (实验组OD值-对照组OD值)/(细胞最大酶活性OD值-对照OD值)×100%。
对正常组织的损伤
将7周龄雌性裸鼠10只(体重25-27g)麻醉后,于一侧背部皮肤皮下注射50ulPTS,对侧注射50ul无水乙醇。注射后用精密游标卡尺测量PTS和无水乙醇对正常皮肤的损伤。按损伤面积按椭圆面积公示S=长径×短径×π/4计算。后取损伤部位皮肤4%多聚甲醛溶液固定,石蜡包埋,制片,HE染色,光镜下观察两组在长径半轴距注射点中心0、0.2、0.5cm处皮肤的病理变化及损伤差异。
数据统计
数据用中位数和95%可信区间表示。采用SPSS13.0进行统计分析。各组之间的比较方差齐性时使用方差分析,组间比较使用SNK法,发差不齐时使用非参数检验法比较。率的比较使用非参数检验。
结果
在体实验
在体实验时裸鼠一般情况
裸鼠均可耐受治疗处理过程,无死亡。PTS组、无水乙醇组用药当天均出现食欲差、行为迟缓等,第2天即恢复正常,两对照组无异常表现。两对照组因肿瘤体积增大而逐渐消瘦。PTS及无水乙醇组在局部注射后24h,肿瘤会产生血痂,两对照组无此现象(图1).
PTS抑制裸鼠移植型肺部肿瘤的生长
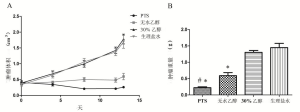
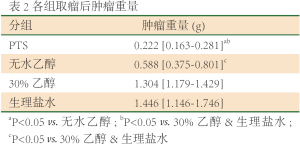
在治疗前,各组的肿瘤体积没有显著性差异(P=0.873)。随着治疗周期数的增加,对照组肿瘤的体积迅速增大,而PTS组和无水乙醇组对肿瘤的生长有明显的抑制作用(表1、图2A)。在第13天取瘤称重(表2、图2B),PTS组和无水乙醇组肿量显著小于两对照组(P

Full Table
Full Table
肿瘤组织病理学分析
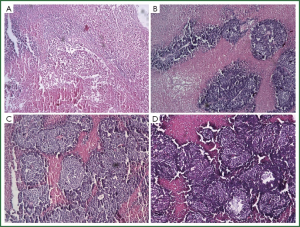
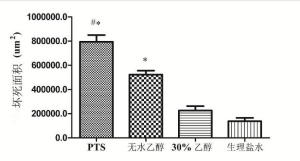
从病理结果看, PTS组、无水乙醇组大部分为坏死组织,红染(图3A、3B)。细胞形态基本消失,只能辨认坏死组织的边界,小部分为存活的肿瘤组织,细胞蓝染,大小、形态不一,核大深染,异形性明显。对照组和30%乙醇组则相反,大部分为存活的肿瘤组织,小部分为坏死组织(图3C、3D)。用软件计算各组坏死的面积(表3、图4),PTS及无水乙醇组的肿瘤坏死面积大于两对照组(P
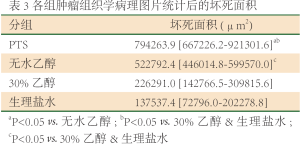
Full Table
离体实验
PTS致H460细胞坏死
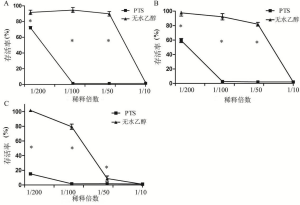
Hoechst33342能透过正常、凋亡及坏死细胞的细胞膜进入细胞质,与细胞内染色质结合,发出蓝色荧光。因结合固缩的细胞核,在凋亡细胞中发出的蓝色荧光强于正常细胞。PI只能在细胞坏死,细胞膜完整性破坏时,进入细胞发出红色荧光。通过观察在荧光显微镜下细胞发出荧光的情况来判断正常、凋亡及坏死细胞。正常细胞的细胞核会被Hoechst33342染色,发出蓝色荧光。凋亡细胞细胞核的荧光会比正常细胞明显增强(蓝色)但不会被PI染色。而坏死细胞则会被Hoechst33342、PI双染。两种注射剂稀释至1/100时,PTS对H460细胞有明显的致坏死作用(表4,图5),而无水乙醇在此浓度未出现坏死(表5)。因此, PTS对H460细胞的致坏死作用强于无水乙醇。/p>
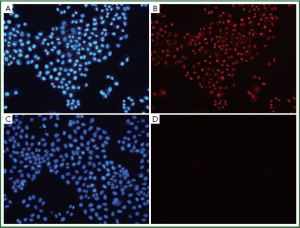
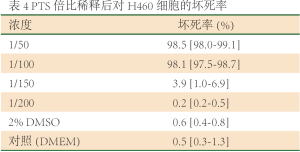
Full Table

Full Table
PTS抑制H460细胞的活性
图6显示了PTS对H460细胞活性的影响。PTS稀释到1/10、1/50、1/100时,在3个时间点对H460细胞的活性有显著的抑制作用。在稀释至1/10时,PTS和无水乙醇在3个时间点对细胞活性均有显著的抑制作用(细胞活性小于10%),之间无显著性差异(P=0.454);但随着稀释倍数的增加,在1/50、1/100,PTS对细胞活性仍有显著的抑制作用,而无水乙醇显著下降。因此,PTS在较低浓度对细胞活性的抑制作用显著强于无水乙醇。
PTS增加H460细胞膜的通透性
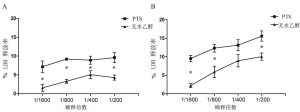
采用LDH释放实验检测并比较PTS和无水乙醇(稀释到1/200、1/400、1/800、1/1600)作用2h、6h,对H460细胞的细胞膜通透性的影响。PTS和无水乙醇在在稀释至不同浓度时均使LDH的释放率增加,而PTS组LDH释放率高于无水乙醇组(P图7A、图7B)。PTS能增加细胞膜通透性,在相同稀释倍数下其影响显著高于无水乙醇。
正常皮肤组织的损伤
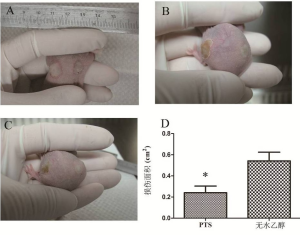
PTS和无水乙醇注射入裸鼠皮下后,较易扩散开。直观上PTS一侧对正常皮肤的损伤面积小于无水乙醇(图8A、8B、8C),与量化后统计结果一致(P表8、图8D)。病理结果示,在PTS及无水乙醇作用到的位置,可见大量表皮及毛囊细胞的坏死(伊红染色)。相反,两种注射剂未作用到的位置,可见大量正常的表皮、毛囊细胞(图9)。从组织形态学角度验证损伤范围的情况,以注射点为中心,选取两组在损伤皮肤长径半轴距注射点中心0、0.2、0.5cm处皮肤的进行分析。虽然在0、0.2cm处,皮肤组织病理均呈坏死的形态特点,两组之间的损伤未见差异(图9A、9B、9D、9E)。但是距注射点中心0.5cm处的皮肤,PTS组呈现正常皮肤组织的形态学特点(图9C),而无水乙醇组仍呈坏死的形态特点(图9F)。这表明PTS对正常皮肤组织的损伤范围小于无水乙醇。
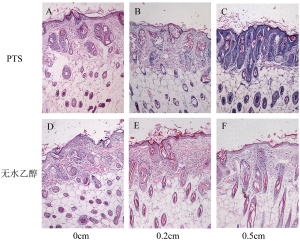

Full Table
讨论
本研究从在体和离体实验水平证明了PTS抗肺部肿瘤的作用。在体实验选取H460肺癌细胞株成瘤,证实了PTS通过致肿瘤坏死治疗裸鼠移植型肺癌的效果,且优于无水乙醇。这与之前文献报道的PTS对肝脏肿瘤的作用结果一致[20]。离体实验中,相同稀释水平下,PTS可能通过对H460细胞的快速致坏死效果、抑制细胞活性和增加细胞膜通透性等途径发挥抗肿瘤效应,且各种作用均强于无水乙醇。
虽然在体实验中,PTS对肿瘤有显著的治疗作用,优于无水乙醇,但是PTS对正常皮肤组织的损伤小与无水乙醇。推测可能因PTS溶剂粘稠度较大,对周围正常组织的弥散局限,导致其损伤范围小于无水乙醇。
传统抗肿瘤药物大多通过影响肿瘤细胞的增殖、凋亡、侵袭等发挥作用。然而,PTS与大多数抗肿瘤药物不同,它的作用快速有效。众所周知,细胞发生凋亡的过程需要一定的反应时间并消耗ATP,且有证据表明,细胞内的ATP水平决定了细胞的死亡方式是凋亡还是坏死[34, 35]。同时,线粒体的功能在细胞死亡方式中起了重要作用[36, 37]。线粒体是细胞内产生新陈代谢所需ATP的主要场所。细胞损伤使线粒体发生功能障碍后,若仍保留有部分功能可产生ATP,细胞将以凋亡的形式死亡。反之,若线粒体功能严重障碍,不能产生足够的ATP,细胞则以坏死的形式死亡。虽然本实验未直接检测细胞内ATP水平,但由于细胞活性实验反映了PTS作用后(浓度为1/10、1/50和1/100)(图6),细胞内线粒体对CCK-8中WST-8的代谢抑制,间接反映了PTS能导致细胞线粒体功能的严重障碍。因此,我们认为PTS能使细胞线粒体功能严重障碍,从而引发细胞的快速坏死。
图5离体实验结果表明PTS对肿瘤细胞的致坏死效果10倍于无水乙醇。PTS在稀释到1/100时,仍表现出强烈的致坏死作用;而无水乙醇在稀释至1/10以下,已不能引起细胞坏死。因此,PTS对离体肿瘤细胞的致坏死作用强于无水乙醇。这与在体实验结果相一致。我们认为,PTS对肿瘤细胞的杀伤效应是一种快速的损伤,效应优于传统注射剂无水乙醇。而对正常组织的损伤效应,因注射剂本身性质特点和注射部位的组织结构特点等原因弱于无水乙醇。
局部注射化疗药物消融肿瘤是多种肿瘤姑息治疗的有效方法。目前最常见注射剂为无水乙醇,常经皮注射用于晚期肿瘤特别是肝脏肿瘤的治疗[38]。无水乙醇主要通过使细胞脱水和蛋白质变性原理起到抗肿瘤作用[39-41]。局部注射虽然有较高的安全性,但曾有单次大剂量的注射治疗引起患者死亡的报道[9]。局部注射无水乙醇在肺部肿瘤治疗方面也有报道,但通常适用在气管镜下治疗气管内的恶性肿瘤[10, 42, 43]。因本身的理化性状使其在肿瘤组织内弥散的边界难以确定,同时需要较大剂量并多次治疗以达到肿瘤组织的坏死。但这可能发生多种并发症(特别是气管支气管的穿孔)。此外,经皮注射无水乙醇有时会出现肺部的多灶性坏死,很可能是注射过程中无水乙醇沿气道播散造成[44] ,致使经皮注射风险增加,限制了其在肺部肿瘤治疗的临床应用。本实验证实了PTS对肺部肿瘤的致坏死作用更强。加之其较粘稠,对周围正常组织的弥散局限,损伤范围小于无水乙醇。此外,现已有多篇报道阐述临床上局部注射PTS的抗实体肿瘤效果显著、安全[45, 46]。因此,PTS可替代无水乙醇成为肿瘤特别是肺部肿瘤,局部消融治疗的主要注射剂。
当然本实验也有局限性。首先,本实验只选取H460一种肿瘤细胞系,并未涵盖所有肺部肿瘤细胞类型。其次,体外实验重点放在快速损伤效应上,尚未深入观察PTS在低剂量长时间作用时对肿瘤的侵袭性、凋亡等方面的影响。因此,仍需后续实验,以完善PTS抗肺部肿瘤的作用机制。
总之,本实验从体外和体内试验两方面证实PTS在抗肺部肿瘤效果均明显优于无水乙醇。体外实验中,PTS通过快速致坏死、抑制细胞活性和增加细胞膜通透性等多方面发挥抗H460肿瘤细胞的效应。因此,我们可推测正在进行的PTS的Ⅱ、Ⅲ期肺部肿瘤的临床实验[47,48]也很可能取得良好的结果。因而,PTS作为一种新的局部应用的化学消融剂在治疗中晚期肺部肿瘤方面,通过与化疗药物联合应用,将可能具有非常好的临床应用前景。
Acknowledgements
Disclosure: The authors declare no conflict of interest.
References
- He J, Gu D, Wu X, et al. Major causes of death among men and women in China. N Engl J Med 2005;353:1124-34. [PubMed]
- She J, Yang P, Hong Q, et al. Lung cancer in China: challenges and interventions. Chest 2013;143:1117-26. [PubMed]
- Mountain CF. Revisions in the International System for Staging Lung Cancer. Chest 1997;111:1710-7. [PubMed]
- Janssen-Heijnen ML, Gatta G, Forman D, et al. Variation in survival of patients with lung cancer in Europe, 1985-1989. EUROCARE Working Group. Eur J Cancer 1998;34:2191-6. [PubMed]
- Bolliger CT, Sutedja TG, Strausz J, et al. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J 2006;27:1258-71. [PubMed]
- Allen AM, Rabin MS, Reilly JJ, et al. Unresectable adenoid cystic carcinoma of the trachea treated with chemoradiation. J Clin Oncol 2007;25:5521-3. [PubMed]
- Haresh KP, Prabhakar R, Rath GK, et al. Adenoid cystic carcinoma of the trachea treated with PET-CT based intensity modulated radiotherapy. J Thorac Oncol 2008;3:793-5. [PubMed]
- Yang X, Xiong W, Gao Y, et al. EUS-guided ethanol injection for treatment of pancreatic cancer. Endoscopy 2011;43:A154.
- Livraghi T, Giorgio A, Marin G, et al. Hepatocellular carcinoma and cirrhosis in 746 patients: long-term results of percutaneous ethanol injection. Radiology 1995;197:101-8. [PubMed]
- Fujisawa T, Hongo H, Yamaguchi Y, et al. Intratumoral ethanol injection for malignant tracheobronchial lesions: a new bronchofiberscopic procedure. Endoscopy 1986;18:188-91. [PubMed]
- Komorowski J, Kuzdak K, Pomorski L, et al. Percutaneous ethanol injection in treatment of benign nonfunctional and hyperfunctional thyroid nodules. Cytobios 1998;95:143-50. [PubMed]
- Lippi F, Ferrari C, Manetti L, et al. Treatment of solitary autonomous thyroid nodules by percutaneous ethanol injection: results of an Italian multicenter study. The Multicenter Study Group. J Clin Endocrinol Metab 1996;81:3261-4. [PubMed]
- Ebara M, Ohto M, Sugiura N, et al. Percutaneous ethanol injection for the treatment of small hepatocellular carcinoma. Study of 95 patients. J Gastroenterol Hepatol 1990;5:616-26. [PubMed]
- Ishii H, Okada S, Nose H, et al. Local recurrence of hepatocellular carcinoma after percutaneous ethanol injection. Cancer 1996;77:1792-6. [PubMed]
- Shiina S, Tagawa K, Unuma T, et al. Percutaneous ethanol injection therapy of hepatocellular carcinoma: analysis of 77 patients. AJR Am J Roentgenol 1990;155:1221-6. [PubMed]
- Di Stasi M, Buscarini L, Livraghi T, et al. Percutaneous ethanol injection in the treatment of hepatocellular carcinoma. A multicenter survey of evaluation practices and complication rates. Scand J Gastroenterol 1997;32:1168-73. [PubMed]
- Da Ines D, Buc E, Petitcolin V, et al. Massive hepatic necrosis with gastric, splenic, and pancreatic infarctions after ethanol ablation for hepatocellular carcinoma. J Vasc Interv Radiol 2010;21:1301-5. [PubMed]
- Ohmoto K, Kunieda T, Shibata N, et al. Intraperitoneal hemorrhage as a major complication of percutaneous ethanol injection therapy for hepatocellular carcinoma. Hepatogastroenterology 2000;47:1199-202. [PubMed]
- Zardi EM, Di Matteo F, Santini D, et al. Pancreatitis after percutaneous ethanol injection into HCC: a minireview of the literature. J Exp Clin Cancer Res 2008;27:28. [PubMed]
- Li MY, Meng H, Zhou SZ, et al. Effect of percutaneous para-toluenesulfonamide injection in treatment of hepatocarcinoma in rats. World chinese journal of digestology 2008;16:1232.
- Meng H, Li MY, Zhu WL, et al. Therapeutic effect of para-toluenesulfonamide on transplanted hepatocarcinoma in nude mice. Nan Fang Yi Ke Da Xue Xue Bao 2009;29:1024-5. [PubMed]
- Wang T, Li Y, Liu M, et al. Anti-cancer Effect of PTS in Vitro. Practic J Cancer 2004;19:1-4.
- Zhou JQ, Tang ZQ, Zhang JN, et al. Metabolism and effect of para-toluene-sulfonamide on rat liver microsomal cytochrome P450 from in vivo and in vitro studies. Acta Pharmacol Sin 2006;27:635-40. [PubMed]
- Chinese Clinical Trial Register [Internet]. Chengdu (Sichuan): Ministry of Health (China). 2007 Jun 27. Identifier ChiCTR-ONC-12002948, A Phase IIa Clinical Trial Treating Patients With Early Stage Head and Neck Tumor (SCCHN & SCSC) for Not Exceeding 7 Days Prior Surgery With PTS (para-toluenesulfonamide injection), A Novel Local Invasive Anticancer Drug, Administered By Local and Intratumoral Injection Therapy; 2012 Dec 31 [cited 2013 May 7]; [1 page]. Available online: http://www.chictr.org/en/proj/show.aspx?proj=4136
- Chinese Clinical Trial Register [Internet]. Chengdu (Sichuan): Ministry of Health (China). 2007 Jun 27. Identifier ChiCTR-ONC-12002946, A Phase IIa Clincal Trial Treating Patients With Early Stage Breast Cancer for Not Exceding 7 Days Prior Surgery With PTS(para-toluenesulfonamide injection), A Novel Local Invasive Anticancer Drug, Administered By Local and Intratumoral Injection Therapy; 2012 Dec 31 [cited 2013 May 7]; [1 page]. Available online: http://www.chictr.org/en/proj/show.aspx?proj=4134
- Chinese Clinical Trial Register [Internet]. Chengdu (Sichuan): Ministry of Health (China). 2007 Jun 27-. Identifier ChiCTR-ONC-12002944, A Phase IIb Clincal Trial Treating Patients with Advanced Palpable Solid Tumor After Failure From Conventional Treatments and Patients Who are Suitable for Palliative Treatments with PTS(para-toluenesulfonamide injection), A Novel Local Invasive Anticancer Drug, by Intratumoral Injection Therapy; 2012 Dec 31 [cited 2013 May 7]; [1 page]. Available online: http://www.chictr.org/en/proj/show.aspx?proj=4132
- Chinese Clinical Trial Register [Internet]. Chengdu (Sichuan): Ministry of Health (China). 2007 Jun 27. Identifier ChiCTR-ONC-12002943, A Phase IIb Clincal Trial Treating Patients with Advanced Liver Cancer with PTS (Para-Toluenesulfonamide Injection), A Novel Local Invasive Anticancer Drug, by Percutaneous Intratumoral Injection Therapy; 2012 Dec 31 [cited 2013 May 7]; [1 page]. Available from: http://www.chictr.org/en/proj/show.aspx?proj=4133
- He J, Ying W, Yang H, et al. Gemcitabine plus cisplatin chemotherapy with concurrent para-toluenesulfonamide local injection therapy for peripherally advanced nonsmall cell lung cancer larger than 3 cm in the greatest dimension. Anticancer Drugs 2009;20:838-44. [PubMed]
- Li MY, Meng H, Zhu WL, et al. Dose-effect relationship of para-toluenesulfonamide for treatment of hepatocellular carcinoma in rats. Nan Fang Yi Ke Da Xue Xue Bao 2008;28:249-51. [PubMed]
- Naito S, von Eschenbach AC, Giavazzi R, et al. Growth and metastasis of tumor cells isolated from a human renal cell carcinoma implanted into different organs of nude mice. Cancer Res 1986;46:4109-15. [PubMed]
- Liu X, Zhang B, Guo Y, et al. Down-regulation of AP-4 inhibits proliferation, induces cell cycle arrest and promotes apoptosis in human gastric cancer cells. PLoS One 2012;7:e37096. [PubMed]
- Newton K, Meyer JC, Bellamy AR, et al. Rotavirus nonstructural glycoprotein NSP4 alters plasma membrane permeability in mammalian cells. J Virol 1997;71:9458-65. [PubMed]
- Hong S, Leroueil PR, Janus EK, et al. Interaction of polycationic polymers with supported lipid bilayers and cells: nanoscale hole formation and enhanced membrane permeability. Bioconjug Chem 2006;17:728-34. [PubMed]
- Tsujimoto Y. Apoptosis and necrosis: intracellular ATP level as a determinant for cell death modes. Cell Death Differ 1997;4:429-34. [PubMed]
- Leist M, Single B, Castoldi AF, et al. Intracellular adenosine triphosphate (ATP) concentration: a switch in the decision between apoptosis and necrosis. J Exp Med 1997;185:1481-6. [PubMed]
- Ankarcrona M, Dypbukt JM, Bonfoco E, et al. Glutamate-induced neuronal death: a succession of necrosis or apoptosis depending on mitochondrial function. Neuron 1995;15:961-73. [PubMed]
- Zamzami N, Hirsch T, Dallaporta B, et al. Mitochondrial implication in accidental and programmed cell death: apoptosis and necrosis. J Bioenerg Biomembr 1997;29:185-93. [PubMed]
- Shiina S, Tagawa K, Niwa Y, et al. Percutaneous ethanol injection therapy for hepatocellular carcinoma: results in 146 patients. AJR Am J Roentgenol 1993;160:1023-8. [PubMed]
- Shiina S, Tagawa K, Unuma T, et al. Percutaneous ethanol injection therapy for hepatocellular carcinoma. A histopathologic study. Cancer 1991;68:1524-30. [PubMed]
- Fujimoto T. The experimental and clinical studies of percutaneous ethanol injection therapy (PEIT) under ultrasonography for small hepatocellular carcinoma. Acta Hepatol Jpn 1988;29:52-9.
- Shiina S, Tagawa K, Unuma T, et al. Percutaneous ethanol injection therapy for the treatment of hepatocellular carcinoma. AJR Am J Roentgenol 1990;154:947-51. [PubMed]
- Sawa T, Ikoma T, Yoshida T, et al. Intratumoral ethanol injection therapy using endoscopic video information system. Gan To Kagaku Ryoho 1999;26:1865-8. [PubMed]
- Morio H, Osegawa M, Matsuoka Y, et al. Effect of ethanol injection in tracheal large cell carcinoma--a case report. Nihon Kyobu Shikkan Gakkai Zasshi 1990;28:623-7. [PubMed]
- Suzuki K, Moriyama N, Yokose T, et al. Preliminary study of percutaneous alcohol injection into the lung. Jpn J Cancer Res 1998;89:89-95. [PubMed]
- He Q, Kuang AR, Guan YS, et al. Puncture injection of para-toluenesulfonamide combined with chemoembolization for advanced hepatocellular carcinoma. World J Gastroenterol 2012;18:6861-4. [PubMed]
- Li S, Yang J, Chen R, et al. Treatment of large airway obstruction due to lung cancer with local injection of Immusyn via bronchoscopy. Guangdong Medical Journal 2001;3:2.
- Chinese Clinical Trial Register [Internet]. Chengdu (Sichuan): Ministry of Health (China). 2007 Jun 27. Identifier ChiCTR-ONC-12002942, A Phase IIb Clinical Study of PTS (Para-Toluenesulfonamide Injection), A Novel Local Invasive Anticancer Drug, Administered Locally and Intratumorally to Patients With Advanced Lung Cancer; 2012 Dec 31 [cited 2013 May 7]; [1 page]. Available online: http://www.chictr.org/en/proj/show.aspx?proj=4137
- Chinese Clinical Trial Register [Internet]. Chengdu (Sichuan): Ministry of Health (China). 2007 Jun 27. Identifier ChiCTR-TNC-12002648, A Phase III Single Arm Trial of PTS (Para toluenesulfonamide Injection) via Bronchoscopy Intervention Intratumoral Injection in Patients with Central Air Way NSCLC Tumor Severe Obstruction; 2012 Nov 05 [cited 2013 May 7]; [1 page]. Available online: http://www.chictr.org/en/proj/show.aspx?proj=3665