路漫漫其修远兮——非小细胞癌的抗血管生成治疗的最新进展
Department of Medical Oncology, Mater Misericordiae University Hospital, Eccles Street, Dublin 7, Ireland
|
Cite this article as: Korpanty G, Smyth E, Carney DN. Update on anti-angiogenic therapy in non-small cell lung cancer: Are we making progress? J Thorac Dis 2011;3:19-29. DOI: 10.3978/j.issn.2072-1439.2010.11.11
Review Article
路漫漫其修远兮——非小细胞癌的抗血管生成治疗的最新进展
Department of Medical Oncology, Mater Misericordiae University Hospital, Eccles Street, Dublin 7, Ireland
|
|
摘要
非小细胞肺癌(NSCLC)依然是全球恶性肿瘤患者的首要死亡原因。近年来,尽管临床研究中新的化疗方案和细胞毒性药物联用治疗层出不穷,但是肺癌患者的预后并没有得到明显改善。NSCLC患者的五年生存率约为15%,仅仅比40年前提高了5%。一些靶向肿瘤进展和转移的各个不同层面的新治疗方法对NSCLC患者尤其重要。抑制肿瘤血管化(血管生成)、干扰生长因子受体活性以及由这些受体激活触发的分子通路的药物已经应用于临床。本文简要介绍了肺癌血管生成的基本机制和使用药物阻断这一过程的基本原理,并对药物临床疗效的现况与进展进行了回顾。
关键词
肺癌;VEGF;血管生成;抗血管生成
J Thorac Dis 2011;3:19-29. DOI: 10.3978/j.issn.2072-1439.2010.11.11
|
|
引言
|
|
肿瘤血管生成
Dr. Judah Folkman于1971年首次提出一项理论,如果恶性肿瘤不通过自身分泌产生可溶性生长因子这个过程形成自身的血管(肿瘤血管生成),达到一定大小之后就不能继续增长(5)。他同时指出,抑制肿瘤血管生成可预防其局部生长和远处转移病灶形成。虽然Judah Folkman的假设在当时备受争议,但它引发了肿瘤血管生成的分子机制以及通过阻断肿瘤血管生成治疗癌症的大量相关研究。
虽然促进肿瘤血管生成的生长因子种类众多,但在其分子机制中发挥最重要作用的是血管内皮生长因子A(VEGF-A)。VEGF最早由Harold Dvorak和Donald Senger在1983年首次发现(6)。1989年,Napoleone Ferrara和Daniel Connolly各自领导的研究小组分别揭示了VEGF的化学结构与基因序列(7,8)。
|
|
抗血管生成剂的作用机制
抗血管生成药抗癌的具体作用并非单一机制可以解释(17)。根据Judah Folkman的假设,阻断血管生长过程可大大影响或彻底消除血管形成,从而减缓肿瘤生长,使肿瘤逆转至临床不可检出的“休眠状态”(5)。
这项假说虽可解释大多数的临床前数据,但是在临床上,肿瘤被检出时已形成了自身的血管网。然而肿瘤血管的生成情况并不均衡。与周细胞联系密切的小部分肿瘤血管,相对于缺乏周细胞支持的血管更具有功能性和稳定性(18)。周细胞所包绕的肿瘤血管通常位于肿瘤外围,并不依赖作为存活因子和生长因子的VEGF。相比之下,大多数肿瘤血管没有周细胞覆盖层的支持,因而显得扭曲、渗漏、不成熟。这些血管的存活和生长依赖于VEGF等生长因子的持续刺激。一旦VEGF被抑制,这些血管将慢慢衰退,而功能稳定、周细胞覆盖的血管网几乎不受影响。因此在抗VEGF治疗后,残留的肿瘤血管系统仍然含有大部分成熟、周细胞覆盖的血管,为肿瘤提供了高效血液灌注。Rakesh Jain将这个过程称为“肿瘤血管正常化”,认为抗血管生成治疗可一过性改善肿瘤内部血供,增强化疗药物的传输效果(19,20)。这个现象不仅可见于动物和临床前期模型,在临床中还可见观察到由抗血管生成治疗导致肿瘤氧合能力一过性改善、放疗效果增高的情况(17)。
|
|
抗血管生成治疗的临床应用
VEGF与其受体结合从而触发一系列分子事件促进肿瘤血管生成(图1)。一般而言,在VEGF信号通路干预方面存在两种主要思路——通过中和/阻滞VEGF分子的方式阻断VEGF受体细胞外结构的活化,或通过酪氨酸激酶抑制剂(TKIs)阻断VEGF受体细胞内酪氨酸激酶结构的活化(21)。
贝伐单抗是一种可与VEGF结合的人类单克隆抗体。它是第一个经过证实与标准化疗联合使用可改善转移性大肠癌患者预后的抗血管生成剂(22)。
阿柏西普是一种重组融合蛋白(VEGF-trap),与贝伐单抗的作用机制相似,可与VEGF和PlGF进行高亲和力结合。它不是抗体,而是一种由VEGFR1 和VEGFR2 细胞外部分与人IgG Fc 片段相融合的“分子构件” (23)。
TKIs与单克隆抗体和融合蛋白不同,是一种对酪氨酸激酶活性有直接影响的小分子物质 (图 2)。TKIs靶向作用的细胞内受体部分在结构上与许多酪氨酸激酶受体相似,因此一种TKI可以干扰多种受体的活性 (24)。.
|
|
抗VEGF治疗肺癌的疗效
2004年,一项临床II期试验探讨了贝伐单抗在初诊为IIIB/IV期或复发性NSCLC患者中的应用 (25)。患者被随机分组接受贝伐单抗7.5 或 15 mg/kg联合卡铂(曲线下面积;AUC = 6)、紫杉醇200 mg/m2的化疗方案,或单纯化疗,每三周一次。主要终点指标为肿瘤进展的中位时间(TTP)和肿瘤治疗反应率(RR)。与单纯化疗(4.2 个月)或低剂量贝伐单抗联合化疗(4.3 个月)的患者相比,高剂量贝伐单抗治疗联合化疗患者的TTP (7.4 个月)得到改善。高剂量组的RR(31.5%)也高于单纯化疗组(18.8%)。三组的总存活期(OS)无统计学显著差异,但是这项研究的统计效能尚不能解决存活率优势这个问题。贝伐单抗总体而言耐受性良好,接受治疗的患者常见高血压、蛋白尿、血栓以及3/4级白细胞减少。这项II期试验中最显著的副作用是出血事件发生频率增加。所有患者的出血事件呈现两种不同方式:轻度皮肤黏膜出血,无需改变治疗方案;或大咯血/肺出血,出现此症状的六名患者中有四名死亡。进一步的分析显示,大多数严重肺出血患者(67%)的肿瘤组织分类属于鳞状细胞,而且是邻近大血管的中央型肿瘤。基于以上结果,今后的贝伐单抗临床研究将排除鳞癌患者。
由于II期试验取得了令人鼓舞的结果,美国东岸癌症临床研究合作组织878名IIIB/IV期NSCLC患者中进行了III期临床试验(E4599研究),其中试验组使用更高剂量的贝伐单抗(15 mg/kg)联合化疗方案,对照组采用单纯化疗 (图 1)(26)。患者被随机分组接受单纯化疗(对照组)、或卡铂(AUC = 6)、紫杉醇200 mg/m2的化疗方案联合贝伐单抗15 mg/kg治疗,每3周一次。患者被随机分为单纯化疗组(对照组),每三周一次卡铂(AUC = 6)联合紫杉醇200 mg/m2化疗或化疗联合贝伐单抗15 mg/kg。6个疗程后,试验组患者继续接受贝伐单抗作为单一治疗,直到疾病进展或出现不可耐受的毒副反应。OS是这项研究的首要评价指标。根据II期研究出现的安全问题,这项研究排除了鳞癌、脑转移瘤、临床大咯血和抗凝治疗的患者。
该项研究实现了主要终点指标,贝伐单抗联合化疗组的中位生存期比单纯化疗组明显改善,延长了2个月,分别为12.3 和10.3个月。联合治疗组的中位PFS及RR显著优于单纯化疗组,分别为6.2 和4.5个月,35% 和15%。尽管研究对象进行了严格筛选(非鳞状细胞癌、咯血或抗凝治疗患者),贝伐单抗治疗联合化疗患者的临床大出血发生率还是高于单纯化疗组,分别为4.4% 和 0.7%。化疗联合贝伐单抗治疗组有15例治疗相关死亡,其中10例死于出血性或血栓并发症(肺出血5例,消化道出血2例,中风2例,肺栓塞1例)。对照组有2例死于治疗的毒性作用。
对贝伐单抗治疗的70岁以上患者预后进行回顾性分析可见,其副作用发生率显著高于年轻患者,而在PFS与OS方面并无优势 (27)。
AVAiL研究采取与ECOG4599研究相似的方法,纳入1043名IIIB/IV期NSCLC患者,对顺铂/吉西他滨单纯化疗与贝伐单抗联合化疗进行了比较 (表 1)(28)。患者经过严格挑选,均为非鳞癌患者,在分组之前的六个月无咯血、脑转移瘤、肿瘤侵犯大血管、高血压控制不佳、脊髓压迫、血栓和出血等病史,经过随机接受顺铂80 mg/m2、吉西他滨1250 mg/m2化疗,外加低剂量贝伐单抗(7.5 mg/kg)、高剂量贝伐单抗(15 mg/kg)或安慰剂治疗,每三周一次,最多六个疗程,直至出现疾病进展。虽然这项研究的效能足以说明OS,但在试验过程中主要终点指标从OS更改为PFS。与单纯化疗组相比(6.1 个月),化疗联合贝伐单抗7.5 mg/kg组(6.7 个月)和15 mg/kg组(6.5个月)的中位PFS均得到改善。在AVAIL研究中最让人意外和疑惑的是,标准化疗中加入贝伐单抗并未体现出存活期的优势,这一点与ECOG4599研究结果不同,这个令人遗憾的研究结果,尚未能得到明确解释。有人提出很多可能的原因,包括该研究的统计学效能不足,或与贝伐单抗联合的双效铂类化疗的类型不合适。大致上来看,AVAiL研究的患者较之E4599研究对象具有更有利的预后因素:更年轻(中位年龄57-59 vs 63岁),8%为不伴恶性胸腔积液的IIIb期患者(E4599研究仅招募恶性胸膜积液的IIIb患者),组织学类型为腺癌(82%-85%)和从未吸烟的患者(22%-26%)比例较高。以上因素可能可以解释在AVAiL研究中,单纯放疗组的中位存活期比E4599研究中对应的患者要多3.2个月,同时它也可能是这一组严格筛选的患者在接受加入贝伐单抗的化疗治疗后结果改善并不显著的原因。
在探讨各种铂类药物双效化疗方案联合贝伐单抗疗效的一些小规模II期试验中,总体治疗反应率随着双效化疗的种类而在30-74%之间变动。但是这些研究目的并不在于显示PFS 或OS的差异 (29-31)。最近公布的一项上市后IV期临床试验(SAiL 研究)结果证实了贝伐单抗与其他含铂药物化疗方案联合应用于非鳞状NSCLC一线治疗时的安全性与毒副作用 (32)。
鳞状NSCLC在所有组织学亚型中大约占25-40%。依据以前的II期试验结果,鳞状细胞癌患者出血并发症风险较高,因此对NSCLC中为数较多的此类患者不推荐贝伐单抗治疗。(25)BRIDGE试验探讨了贝伐单抗后期给药治疗鳞状细胞肺癌的安全性(同理,脑转移瘤患者也要排除在贝伐单抗常规使用范围之外。
PASSPORT研究评估了贝伐单抗联合化疗对手术、全脑放疗或立体定向放疗等手段治疗脑转移瘤患者的疗效(34)。试验中未观察到脑出血发生率增加。目前正在进行的一项贝伐单抗研究(NCT00800202)纳入了未经治疗的无症状性脑转移的非鳞状NSCLC患者,可能更清楚阐明贝伐单抗用于中枢神经系统转移性病灶患者的问题(www.clinicaltrials.gov)。
与结合VEGF的单克隆抗体相似,阿柏西普(VEGF Trap)也进入了II期临床试验,作为单药治疗98例铂类和埃罗替尼耐药的IIIB/ IV期肺腺癌患者(35)。这项研究的主要终点指标为反应率,附加终点指标还包括安全性、反应持续时间、PFS和OS。患者接受每两周一次的阿柏西普静脉注射,直至疾病进展或出现不可耐受的毒副作用。阿柏西普作为单药治疗这一组接受过大力治疗的患者,疗效十分有限,整体反应率为2.0%,中位PFS为2.7个月,OS为6.2个月。常见的3/4级不良反应包括呼吸困难(21%),高血压(23%)和蛋白尿(10%)。
 |
|
NSCLC的多靶点治疗
有力的临床前证据可以证明在癌症患者中,EGF通路与VEGF通路之间存在密切关系(38)。我们可以预期,不同的药物作用于这两个通路可能会对肿瘤进展产生叠加或协同的抑制作用。EGF通路可通过阻滞EGFR的单克隆抗体(西妥昔单抗、帕尼单抗)或干扰EGFR激活的TKIs(厄洛替尼、吉非替尼)来调节。目前已经确证TKIs的临床活性与EGFR的酪氨酸激酶编码区域内的特异性基因突变有关(39)。在特殊患者群体(不吸烟者、亚洲人群、组织学为腺癌)中,这些突变的发生率较高,因此用药后得到临床效益最大。
有一项贝伐单抗和厄洛替尼联合治疗IIIB/IV期非鳞状NSCLC的I/II期试验对这种双重阻断治疗NSCLC的设想进行了评价(40)。大多数患者的肿瘤组织分型为腺癌,且为当前或既往吸烟者。被纳入研究的40名患者中,8例对治疗部分反应,26例病情稳定。贝伐单抗和厄洛替尼之间无药动学相互作用,严重不良反应也未发生。
有人还探讨了贝伐单抗联合EGFR TKI在铂类药物化疗期间或之后疾病进展患者中的应用(41)。在II期临床试验中,120例患者被随机分为三组:1、贝伐单抗联合多西紫杉醇或培美曲塞化疗组,2、贝伐单抗与厄洛替尼联合治疗组,3、单纯化疗组。单纯化疗组、贝伐单抗联合化疗组和贝伐单抗联合厄洛替尼组的中位PFS分别是3个月、4.8和4.4个月。单纯化疗组、贝伐单抗联合化疗组、贝伐单抗联合厄洛替尼组的中位OS时间分别为8.6、12.6和13.7个月,一年生存率分别为33.1%,53.8%和57.4%。然而,贝伐单抗联合化疗组和贝伐单抗联合厄洛替尼组之间的PFS或OS无显著差异。
这些发现推动了多靶点治疗NSCLC的III期临床试验策划。研究贝伐单抗联合厄洛替尼治疗NSCLC的III期临床试验至少有两项。ATLAS试验(AVF3671g研究)比较了贝伐单抗联合厄洛替尼或贝伐单抗单项用药在IIIB/IV期NSCLC患接受铂类药物化疗联合贝伐单抗治疗四个疗程后作为巩固治疗的疗效(42)。ATLAS试验结果表明,与化疗后单用贝伐单抗相比(3.7个月),贝伐单抗联合厄洛替尼治疗可改善PFS(4.8个月)。ATLAS研究虽无检验OS差异的效能,但据初步分析,贝伐单抗联合厄洛替尼可以改善OS。
Ⅲ期BETA肺试验比较了厄洛替尼联合贝伐单抗、厄洛替尼加安慰剂作为晚期NSCLC二线治疗的疗效。遗憾的是,联合治疗组并没有达到改善OS的主要终点指标(43)。
|
|
肺癌中酪氨酸激酶抑制剂的多靶点作用
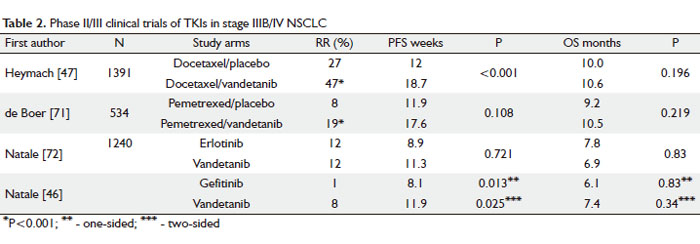
TKIs靶向多种受体的活性(24,44)。凡德他尼(Zactima,ZD6474)是一种小分子TKI,可阻断EGFR、VEGFR-1、 -2、-3和转染重排基因编码的酪氨酸激酶(RET)(45)。在一项II期试验中,有人用凡德他尼或厄洛替尼单剂治疗晚期铂类耐药的NSCLC患者。与厄洛替尼组的8.1周相比,凡德他尼组将PFS显著延长至11.9周(见表1)。凡德他尼的相关副作用如皮疹、腹泻和高血压等均不难控制,与TKIs的一般毒性反应相同。两个研究组之间OS无差异(46)。
有一项II期临床试验评价了凡德他尼与多西紫杉醇联用作为晚期NSCLC患者二线治疗的疗效。与多西紫杉醇单剂治疗相比,凡德他尼100mg/d与多西紫杉醇联合治疗使已经接受过NSCLC治疗的患者的PFS和RR提高了6.7周和20%,分别为12周和18.7周,27%和47%(见表2)(47)。此外,探索性亚组分析表明,凡德他尼100mg/d联合多西紫杉醇治疗相对于多西紫杉醇单剂治疗的PFS改善幅度在女性患者中大于男性。凡德他尼的剂量由100mg增加至300mg后疗效并未改善,因此在III期试验中的剂量为100mg。遗憾的是,另一项随机III期临床试验对这种联合治疗方案进行验证后并未观察到在预后方面的潜在改善作用。Zactima与多西紫杉醇联合治疗NSCLC的研究(简称ZODIAC研究)是一项安慰剂对照的III期研究,纳入IIIB / IV期NSCLC患者,随机分组接受多西紫杉醇单剂或多西紫杉醇联合凡德他尼100 mg的二线治疗 (48)。与多西紫杉醇单一治疗组相比(3.2个月),凡德他尼100mg联合多西紫杉醇治疗组的中位PFS仅延长了0.8个月(4.0个月)。OS没有改善。
探索性分析结果提示,EGFR基因拷贝数和EGFR突变状态对于筛选出IIIB / IV期NSCLC经过凡德他尼联合多西紫杉醇二线治疗效果最佳的患者具有一定程度的预测价值。(49)。
EPHYR试验在既往接受过铂类化疗和抗EGFR TKI治疗失败的晚期NSCLC患者中,探讨了凡德他尼单一疗法相对于安慰剂的临床疗效 (50)。尽管凡德他尼组的PFS更长,这项试验并未达到其主要终点指标,也就是证明凡德他尼较之安慰剂在这群既往经过大力治疗的患者中取得OS方面的获益。
有关这种药物的临床试验,目前在研的有:凡德他尼+卡铂+紫杉醇联合方案作为可切除性NSCLC的新辅助联合化疗,或作为卡铂和多西紫杉醇联合化疗晚期NSCLC之后的巩固治疗。一项III期临床试验(Zactima 联合Alimta治疗肺癌的疗效,简称 ZEAL试验)正在评估凡德他尼结合培美曲塞治疗晚期NSCLC的疗效 (51)。
舒尼替尼(索坦,SU11248)、索拉非尼(多吉美,BAY 43-9006)以及西地尼布(Recentin,AZD2171)是阻滞VEGFR-1、-2、-3以及PDGF受体、RET和c-kit的多靶点酪氨酸激酶抑制剂 (24,52)。
ESCAPE试验研究了卡铂/紫杉醇的铂类双效标准化疗方案联合索拉非尼作为一线方案治疗晚期NSCLC的临床疗效。这项研究没有达到主要终点指标,而且因为鳞癌患者加用索拉非尼后出现副作用而不得不提前终止 (53)。有一项随机、安慰剂对照的II 期临床试验(E2501)表明,索拉菲尼单药治疗较之安慰剂而言,对于既往化疗至少有过两次失败的NSCLC患者具有某些临床效益(54)。最近的回顾性分析表明,在接受过多种化疗方案的人群中,携带VEGF 基因某种多态性的患者可从索拉非尼治疗中获益更多 (55)。
但是最近公布的一项II期试验结果显示,西地拉尼联合卡铂/吉西他滨一线治疗对RR,PFS或OS无明显改善 (56)。
目前进行的几项早期临床试验正在对一些主要阻断VEGER的小分子TKIs,如帕唑帕尼、阿西替尼、莫特塞尼(AMG 706)等治疗NSCLC的疗效进行评估。这些试验有几项获得了令人鼓舞的早期临床资料,有望揭示肺癌分子靶向治疗相关的复杂问题 (57,58)。
多靶点药物治疗相关的综合毒性具有临床重要性,在新试验的设计中不容忽视。最近一项舒尼替尼结合贝伐单抗、卡铂和紫杉醇联合治疗NSCLC的研究(SABRE -L试验)就因为患者对联合化疗的耐受性不佳而提前终止。(www.clinicaltrials.gov)。
 |
|
肺癌中血管阻断剂的应用
血管阻断剂(VDAs)可靶向作用于肿瘤已形成血管的内皮细胞和周细胞。VDA分为两种类型:定向配基VDA和小分子VDA。定向配基VDA的靶向分子与效应分子相互偶联,由于毒性大,缺乏特异性,因此临床疗效受限。小分子VDA包括两型:诱发局部细胞因子生成的黄酮类化合物以及微管蛋白结合剂 (59,60)。
FALCON试验研究了CA4P(康普瑞汀A4前药的单氨丁三醇盐)与卡铂/紫杉醇/贝伐单抗化疗方案联用的疗效。50例IIIB / IV期NSCLC患者随机分为化疗/贝伐单抗/CA4P组和化疗/贝伐单抗/安慰剂组。初步数据表明CA4P治疗组生存状况改善,但目前尚未有比较成熟的数据 (61)。
ADVANCE研究将化疗后疾病进展的IIIB / IV期NSCLC患者随机分组接受多西紫杉醇单纯化疗和化疗联合血管阻断剂Plinabulin(NPI -2358)治疗 (62)。虽然试验者招募仍在进行中,一些初步分析结果已经令人欣慰:联合治疗组的部分反应率为22%,多西紫杉醇单纯化疗组为5%。
目前有多项临床试验正在研究化疗与VDA联合治疗在晚期NSCLC中临床疗效 (63)。
|
|
未来方向
20世纪70年代NSCLC确诊患者的5年生存率为10%。在过去的40多年间,我们仅仅将这个比例提高到15%。肺癌患者存活人数为什么如此之少,要回答这个问题绝非易事。肺癌的生物学特性和自然病程在很大程度上造就了大多数患者到不可能治愈的晚期/转移性阶段才得到确诊这个事实。
多年前有人主张,如果要改善NSCLC的临床结果,研究重点必须从细胞毒性化疗转移到其他的治疗方式上(64)。到目前为止,有一项III期临床试验证明标准铂类化疗基础上加入抗血管生成剂对IIIB / IV期NSCLC患者存活率有好处。经过选择的患者对抗血管生成疗法可产生反应,肿瘤缩小,病情稳定,但是这个结果在目前进行的大部分试验中远远没有达到临床意义水平 (65)。目前有600多项临床试验正在晚期NSCLC患者中对将近100种新药进行测试 (www.clinicaltrials.gov)。当前,肿瘤学界面临着来自大量小规模临床试验研究多种抗血管生成药物所取得的的初步数据。但我们仍然不知道这些临床应用前景良好的新药中哪些应该进行大规模III期试验,更重要的是,哪些患者会从中受益最多。
近年来,晚期NSCLC患者个体化治疗的新方法显得越来越重要。在制定化疗方案时,我们会考虑NSCLC的组织学亚型(腺癌或鳞癌),EGFR酪氨酸激酶区域是否存在特定突变,肿瘤组织中是否有EML-ALK4融合基因 (66-68)。但是目前可以推荐个体化治疗的患者人数仍然不多,我们正在开展基础或转化医学研究,以便明确新的分子靶点 (69,70)。虽然很多肿瘤科医生和患者对肿瘤血管生成的临床靶向治疗效果并不满意,但这些疗法为晚期NSCLC患者单纯进行细胞毒性化疗提供了一种替代方案,而经过筛选的患者可能从中获得一定的生存效益。目前,作为VEGF单克隆抗体的贝伐单抗已经获准与铂类化疗联合治疗身体状况良好、组织学为非鳞状细胞且在临床上无明显咯血的IIIB / IV期NSCLC患者。具有抗血管生成作用的TKI厄洛替尼已经获准用于NSCLC铂类全身化疗后疾病进展患者的二线治疗。抗血管生成药物在不能手术切除/转移性NSCLC治疗中的临床效益有限,部分原因可能是肿瘤血管生长因子种类繁多。如果要对肿瘤进展产生显著的临床影响,以单一血管生成因子为靶点的治疗可能不是最佳方法。联合各种药物序贯靶向不同的促血管生成因子,或联合各种作用机制不同的药物(例如单克隆抗体与TKIs联用),可能更能有效抑制肿瘤血管生成。
我们期望目前正在进行的靶向治疗研究今后将显著改善NSCLC患者的生存。
|
|
References
|