电视辅助胸腔镜肺活检(VATS)在间质性肺疾病中的诊断价值及安全性
Introduction
间质性肺疾病(ILD)是一组由不同病因引起,主要累及肺间质、肺泡和(或)细支气管的异质性肺部弥漫性疾病。虽然在临床表现和病理生理上有很多共性,但各种不同的ILD在病因、病理改变、治疗方案及疾病预后等方面却有所差异。明确ILD诊断及分类对于制定治疗方案及评估患者预后具有重要价值。美国胸科学会(ATS)/欧洲呼吸学会(ERS)于2002年制订的特发性间质性肺炎(IIP)分类标准[1]以及ATS/ERS/日本呼吸学会/拉丁美洲胸科学会专家委员于2011年共同发表的特发性肺纤维化(IPF)诊疗指南[2]均强调了外科肺活检(SLB)对于明确诊断的重要地位:推荐对于临床不典型或诊断不明确的ILD患者,在权衡利弊后应积极进行SLB,尽早明确诊断,给予相应治疗。
近年来,由于胸部高分辨率计算机断层扫描(HRCT)及支气管镜肺活检(TBLB)技术的发展,人们对于SLB的必要性提出了质疑[3]。虽然有些研究表明,依靠临床资料及高质量胸部HRCT表现也可以对大多数特发性间质性肺炎(IIP)的患者做出正确的诊断[4],然而,由于受诊断医生认识水平和经验的影响,诊断的变异性大,误诊率较高[5]。一项多中心研究表明,即使联合临床特征、HRCT以及TBLB结果对疑似IPF患者进行诊断,这些诊断方法的敏感性和特异性仅介于60-80%[6]。另外,受取材标本量及取材部位局限性的影响,TBLB往往不能对ILD提供明确的病理诊断:一项对于21例已确诊为IPF的回顾性研究发现,17例(81%)TBLB可获得足够的标本量,其中能提供明确诊断的仅有7例(32%),而SLB的诊断率则高达95.4%[7]。
外科肺活检在ILD的诊断及治疗中具有重要意义。一项对80例疑诊ILD患者的回顾性研究发现,约有40%最后诊断为IPF的患者需要依靠SLB确诊[8]。北京朝阳医院对61例诊断不明确的ILD进行了外科肺活检,其中56例(94.1%)患者得到了明确诊断,53例(87%)患者的治疗方案获得了更有针对性的改进[9]。一项对58例诊断为弥漫性肺损伤(DAD)的回顾性研究发现,在胸部HRCT及TBLB/肺泡灌洗液(BAL)均不能明确诊断的情况下,SLB不仅有助于明确病因,更使其中87%患者获得了特异性治疗,提高了患者的存活率[10]。
已有多项研究对SLB的安全性进行了评估:一项对于1997-2006年2223例外科肺活检的荟萃分析的结果表明:SLB术后30天死亡率为4.5%(3.7-5.5%)[11];Lettieri 等的资料显示:SLB术后30天及90天的死亡率分别为4.8和6%[8];肺部弥散功能下降(DLCO 12, 13]。
目前关于SLB在ILD诊断中的地位尚有争议,争议的热点主要为SLB的应用范围及安全性。本研究的目的主要为探讨VATS在诊断不明确的ILD中的诊断价值以及手术的安全性;除此之外,也将进一步分析影响VATS术后并发症发生的危险因素。
对象与方法
对象
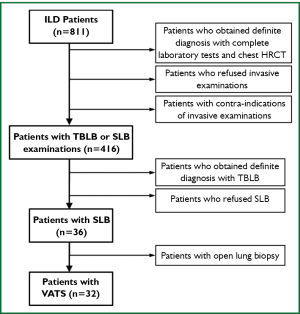
收集2007年1月至2011年12月于广州医学院第一附属医院呼吸内科住院的ILD患者的临床资料,并筛选出经SLB检查的患者。所有患者均依据ATS/ERS专家推荐的IIP/IPF诊断流程进行诊断[1, 2],研究纳入标准:SLB术前经血常规、尿常规、大便、动脉血气分析、电解质、肝肾功能、血清风湿免疫学指标、肿瘤标志物、感染病原学、心脏彩色超声、肺功能及胸部HRCT等常规无创检查及TBLB检查均不能明确诊断的患者;SLB术后随访至少3个月(90天)。排除标准:需要使用机械辅助通气(MV),DLCO图1。
方法
收集患者临床资料:年龄、性别、体质指数(BMI)、吸烟指数、术前用药情况(免疫抑制剂及激素);术前及术后生命体征、血气分析及肺功能指标(FVC%、FEV1%、FEV1/FVC、TLC、RV、DLCO%)。VATS根据术前胸部HRCT进行定位。记录VATS相关情况,包括活检部位、取材数量、麻醉方式、术后胸管放置天数以及术后并发症(肺膨胀不全、肺不张、肺炎、急性呼吸衰竭、支气管痉挛、气胸、气管插管、血胸、急性肾功能不全)。记录术后30天及90天随访结果。最后诊断由呼吸内科、放射科及病理科医师共同商议明确。
统计学方法:组间比较使采用非配对t检验及chi-squared检验。所有数据资料用SPSS16.0统计软件进行分析,p
结果
该研究共纳入811例ILD患者,有416例(51.3%)患者进行有创伤性检查,包括TBLB和SLB,有36例(4%)患者进行SLB检查,从中筛选出32例(3.9%)经VATS检查的患者。其中男性20例(62.5%),女性12例(37.5%),平均年龄为52.2岁(30-76岁)。平均体质指数为23.7(18.0-30.3)。吸烟患者11例(34.4%),其中8例(25.0%)为重度吸烟患者(吸烟指数>400年支)。术前使用免疫抑制剂患者5例(15.6%),使用激素患者21例(65.6%)。患者术前血气分析结果如下:PaO2:78.4mmHg(49.1-121.1mmHg), PaCO2:37.52mmHg(30.5-45.1mmHg)。
患者胸部影像学异常于HRCT上主要以肺底分布为主(50%),其次为随机分布(34.4%)及上肺分布(15.6%)。特征性表现包括:磨玻璃影(87.5%)、肺内网格状影(65.6%)、斑片状实变影(43.8%)、肺大泡(25%)、蜂窝影(21.9%)、胸膜增厚粘连(21.9%)、胸膜下线影(18.8%)、团块结节影(12.5%)、肺气肿(6%)、胸腔积液(6%)以及纵隔淋巴结肿大(6%)。
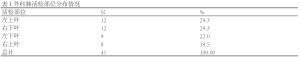
32例患者中,29例(90.6%)实施全身麻醉,3例(9.4%)使用局部麻醉。手术共获取41份SLB肺组织标本:其中9例(28.1%)患者在相同肺叶各取2份,余23例(71.9%)患者各取1份标本;21例(50%)标本来源于左肺,20例(50%)标本来源于右肺。活检部位分布总结于表1。
Full Table
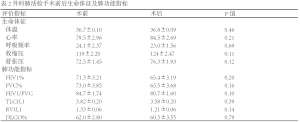
术后胸管放置天数平均为2.72天(0-8天),其中5例(15.6%)于手术后即可拔除胸管。拔除胸管后2-3周评价患者生命体征以及肺功能各项指标较术前无明显改变(表2)。21例(65.6%)患者发生术后并发症,包括肺部感染、肺不张、气胸、肺膨胀不全、急性呼吸衰竭、气管插管及血胸。术后30天死亡率为0,术后90天1例患者因肺部感染死亡,该患者术后并无手术并发症发生(表3)。
Full Table

Full Table
32例患者于SLB术后均获得明确诊断,其中20例(62.5%)为术前诊断不明,7例(21.9%)于术后更改诊断,5例(15.6%)术后与术前诊断相同。20例术前诊断不明的ILD患者中,14例(70.0%)诊断为非特异性间质性肺炎(NSIP),3例(15.0%)诊断为IPF,3例(15.0%)诊断为结缔组织病相关性间质性肺炎(CTD-ILD);7例更改诊断的患者中,4例(57.1%)为隐源性机化性肺炎(COP)(表4)。

Full Table
进一步分析影响术后并发症发生的危险因素:根据患者是否存在术后并发症分为两组:两组患者在年龄、BMI、吸烟指数、术前肺功能、麻醉方式、术后胸管放置天数、有无使用免疫抑制剂或激素治疗方面均无明显差异。
讨论
ILD是一组在病因、病理改变、病情进展、治疗方案及疾病预后等方面差异性较大的一组疾病。胸部影像学以及支气管镜技术的发展对ILD的诊断带来极大的推动性作用[14, 15]_然而,对于那些没有明确环境因素及全身系统性疾病表现的ILD患者,仅依靠临床和影像学资料显然是不够的[6]。而受到取材部位与标本量的影响,TBLB检查有时也不能获得明确的诊断[7],在这种情况下,SLB对于疾病的诊断是十分必要的。
目前,关于SLB在ILD诊断中的地位及应用范围仍有争议。临床实践中不少医师对外科肺活检持非常谨慎的态度,主要原因可能是认为肺活检结果并不能改变已有的诊断结果与相应的治疗方案[16],而且,手术存在加重患者病情及增加患者死亡率的风险。
本研究中共纳入811例疑诊ILD的患者,仅有32例(3.9%)实施了VATS。在该人群中,VATS对于疾病的特异性诊断率为100%,并且使84.4%患者更改了原有诊断。这一数据高于目前已有的报道[8-10, 15]。需要注意的是,所有入选患者在外科肺活检术前均依循严格的诊断流程(包括TBLB检查)。因此,该数据表明,在TBLB检查不能获得明确诊断的前提下,SLB仍可作为一项可靠的检查手段进行实施。
根据入选患者的影像学特征分析,有28例表现为磨玻璃影,21例为网格影,14例为斑片状实变影,说明肺部病变分布不典型可能是ILD患者需要接受VATS的重要原因之一。另一方面,4例最后诊断为COP的患者,影像学表现均为斑片状实变影及团块结节影。因此,疑诊COP而影像学表现为斑片状实变影及团块结节影,VATS可能是重要的鉴别诊断手段之一。有研究表明,活检部位选择及所获标本数量可能会影响VATS诊断的特异性。 Gaensler等认为由于舌叶或中叶病变不具代表性,因此活检应避免在此处进行[17];而Morell等发现,通过舌叶或中叶活检得出的诊断与其他部位基本一致[18]。本研究41份肺活检标本中,并未从中叶或舌叶取材,因此暂不能分析活检部位对于明确诊断的影响。另外与Fibla等的结果相类似[15],我们发现对于大部分(71.9%)患者,单一的外科肺活检标本可能已经足够对ILD做出特异性诊断。
在32例获得明确诊断的患者中,最常见的诊断为NSIP(50%),其次为IPF(12.5%)。这一结果与国内一些报道相似[9],而与国外文献报道有所差异:经SLB检查确诊的患者最常被诊断为IPF(26-30%)。这一差异可能有以下原因:1. 国外ILD疾病种类的分布情况与我国不同,IPF最为常见[15];2. 诊断为NSIP的患者中有一部分为结缔组织病的早期表现[16, 19],而国外由于分诊制度的差异及风湿科的发展,并未将这一部分患者作为SLB的候选人群;3. 本研究样本量较小,尚不足以反映我国其他地区及其他医院的情况。因此,多学科包括风湿科的合作及国内多中心研究对于进一步明确SLB的应用范围及价值有着重要的意义。
根据多项研究数据报道,SLB术后并发症总的发生概率为16-71%,包括肺部感染、气胸、气管插管、急性呼吸衰竭、持续性漏气等[11,20, 21]。本研究中有65.6%患者发生术后并发症,最常见为肺部感染(56.3%)、肺不张(28.1%)以及气胸(25.0%)。该数据说明虽然术后并发症发生的几率较高,但最常见为肺部感染,提示注意手术过程中无菌操作及术后常规使用抗生素可能是预防术后肺部感染的重要措施。进一步分析发现:患者年龄、BMI、吸烟指数、术前肺功能、麻醉方式、术后胸管放置天数、使用免疫抑制剂或激素治疗对术后并发症的发生均无明显影响,。
与术前FEV1%、TLC、FVC%及DLCO%等指标比较,患者术后3周内肺功能有下降趋势,虽然没有统计学差异,该结果提示VATS对于肺功能可能存在轻度的影响。另一方面,患者生命体征于术后3周内恢复至术前水平,证明这些术后并发症并未影响到患者预后,可能由于目前VATS操作技术已很成熟,与传统开胸手术比较,因手术操作导致的肺部损伤已明显减低。然而,由于本研究样本量较小,扩大样本量或在随访过程中密切观察肺功能变化可能可以进一步证实本研究结果。
术后死亡率也是临床医师在权衡SLB利弊时考虑的一项因素。一项对于1997-2006年2223例外科肺活检的荟萃分析的结果表明:SLB术后30天死亡率为4.5%(3.7-5.5%)[11],而Lettieri 等的资料则显示SLB术后90天的死亡率为6%[8]。持续性MV、DLCO
总之,本回顾性研究证实,电视辅助胸腔镜肺活检对于临床症状不典型或诊断不明的ILD患者具有极其重要的诊断价值,而且,在严格筛选患者、熟练的操作技术及充分术后护理的前提下,VATS是相对安全的。本研究对于明确VATS的应用范围及安全性提供了理论依据,不仅有一定的临床指导价值,而且为将来进行更大样本、多中心的前瞻性研究奠定了良好的基础。
Acknowledgements
Disclosure: The authors declare no conflict of interest.
References
- Demedts M, Costabel U. ATS/ERS international multidisciplinary consensus classification of the idiopathic interstitial pneumonias. Eur Respir J 2002;19:794-6. [PubMed]
- Raghu G, Collard HR, Egan JJ, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med 2011;183:788-824. [PubMed]
- Halkos ME, Gal AA, Kerendi F, et al. Role of thoracic surgeons in the diagnosis of idiopathic interstitial lung disease. Ann Thorac Surg 2005;79:2172-9. [PubMed]
- Flaherty KR, King TE Jr, Raghu G, et al. Idiopathic interstitial pneumonia: what is the effect of a multidisciplinary approach to diagnosis? Am J Respir Crit Care Med 2004;170:904-10. [PubMed]
- Flaherty KR, Andrei AC, King TE Jr, et al. Idiopathic interstitial pneumonia: do community and academic physicians agree on diagnosis? Am J Respir Crit Care Med 2007;175:1054-60. [PubMed]
- Hunninghake GW, Zimmerman MB, Schwartz DA, et al. Utility of a lung biopsy for the diagnosis of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2001;164:193-6. [PubMed]
- Berbescu EA, Katzenstein AL, Snow JL, et al. Transbronchial biopsy in usual interstitial pneumonia. Chest 2006;129:1126-31. [PubMed]
- Lettieri CJ, Veerappan GR, Helman DL, et al. Outcomes and safety of surgical lung biopsy for interstitial lung disease. Chest 2005;127:1600-5. [PubMed]
- Ye Q, Dai H, Huang H. Respiratory critical care medicine: 2010-2011. People’s Medical Publishing House, 2011.
- Parambil JG, Myers JL, Aubry MC, et al. Causes and prognosis of diffuse alveolar damage diagnosed on surgical lung biopsy. Chest 2007;132:50-7. [PubMed]
- Kreider ME, Hansen-Flaschen J, Ahmad NN, et al. Complications of video-assisted thoracoscopic lung biopsy in patients with interstitial lung disease. Ann Thorac Surg 2007;83:1140-4. [PubMed]
- Sigurdsson MI, Isaksson HJ, Gudmundsson G, et al. Diagnostic surgical lung biopsies for suspected interstitial lung diseases: a retrospective study. Ann Thorac Surg 2009;88:227-32. [PubMed]
- Yang W, He B. Complications of lung biopsy in patients with idiopathic interstitial pneumonia and risk factors thereof. Zhonghua Yi Xue Za Zhi 2009;89:109-13. [PubMed]
- Ravini M, Ferraro G, Barbieri B, et al. Changing strategies of lung biopsies in diffuse lung diseases: the impact of video-assisted thoracoscopy. Eur Respir J 1998;11:99-103. [PubMed]
- Tiitto L, Heiskanen U, Bloigu R, et al. Thoracoscopic lung biopsy is a safe procedure in diagnosing usual interstitial pneumonia. Chest 2005;128:2375-80. [PubMed]
- Dixon S, Benamore R. The idiopathic interstitial pneumonias: understanding key radiological features. Clin Radiol 2010;65:823-31. [PubMed]
- Fibla JJ, Molins L, Blanco A, et al. Video-assisted thoracoscopic lung biopsy in the diagnosis of interstitial lung disease: a prospective, multi-center study in 224 patients. Arch Bronconeumol 2012;48:81-5. [PubMed]
- Sun YC. Surgical lung biopsy in the diagnosis of idiopathic interstitial pneumonias. Zhonghua Jie He He Hu Xi Za Zhi 2007;30:243-5. [PubMed]
- Gaensler EA, Carrington CB. Open biopsy for chronic diffuse infiltrative lung disease: clinical, roentgenographic, and physiological correlations in 502 patients. Ann Thorac Surg 1980;30:411-26. [PubMed]
- Morell F, Reyes L, Doménech G, et al. Diagnoses and diagnostic procedures in 500 consecutive patients with clinical suspicion of interstitial lung disease. Arch Bronconeumol 2008;44:185-91. [PubMed]
- Ishie RT, Cardoso JJ, Silveira RJ, et al. Video-assisted thoracoscopy for the diagnosis of diffuse parenchymal lung disease. J Bras Pneumol 2009;35:234-41. [PubMed]
- Huang H, Xu ZJ, Zhu YJ, et al. Clinical analysis of different pathological patterns of nonspecific interstitial pneumonia. Zhonghua Jie He He Hu Xi Za Zhi 2006;29:747-50. [PubMed]