胸腔镜下系统性淋巴结清扫与传统开胸手术在可切除非小细胞肺癌中的对比研究
前言
肺癌是严重危害人类健康和生命的疾病,近年来其在世界范围内的发病率和死亡率呈明显上升趋势,在全球范围而言,无论是对于发达国家还是发展中国家,肺癌的发病率和死亡率均己跃居至癌症的首位[1]。虽然,目前治疗肺癌的方法有很多,但对于早中期的非小细胞肺癌公认的首选治疗方案是手术切除,而标准的手术方式为肺叶切除联合系统性淋巴结清扫的肺癌根治术。早在1983年Martini等[2]就率先报道了采用肺叶切除联合纵隔淋巴结切除术治疗原发性肺癌。
随着微创技术在外科领域被广泛应用,而电视胸腔镜(video-assisted thoracic surgery ,VATS)在非小细胞肺癌治疗中的应用,也越来越多的受到胸外科医生的重视。VATS手术因其有着创伤小,术后的疼痛减少,对呼吸肌和术后肺功能损伤小等优势,最早于1992年就开始应用肺叶切除术治疗肺癌[3]。而在1995年McKenna等[4]就首次报道了VATS肺叶切除联合纵隔淋巴结切除术治疗原发性肺癌。
淋巴结清扫的彻底性是肺癌综合治疗的关键之一,它可以明确分期、判断预后、指导下一步治疗,同时可以提高局部控制率、延长无病生存时间。根据欧洲胸科医生协会(European Society of Thoracic Surgeons,ESTS) 发布的指南指出,无论是VATS还是开胸手术,针对可切除的非小细胞肺癌均应进行系统的淋巴结清扫[5]。VATS是否能彻底的进行纵隔淋巴结清扫,且达到与开胸手术相同的效果,一直是争论焦点之一。目前已有文献报道VATS对比开胸手术行肺叶切除联合系统淋巴结清扫治疗可切除的非小细胞肺癌,所获得的结果各有不同[6-14]。但到目前为止,所有文献报道的VATS对比开胸手术进行系统淋巴结清扫治疗可切除的非小细胞肺癌的病例数均较少,不足全面评估对比VATS和开胸手术进行系统淋巴结清扫的有效性和安全性。本文旨在通过对多中心、大样本的临床数据进行回顾性分析,以了解VATS进行系统淋巴结清扫的有效性和安全性。因此,我们现报道如下:
资料和方法
临床资料
系统性回顾分析了从2001年1月至2008年1月国内8家医疗机构接受VATS或开胸肺叶切除联合系统性淋巴结清扫术的非小细胞肺癌患者的临床资料,从中选取了5620例患者纳入本次研究。所有入选患者术前均常规接受相关术前准备工作:戒烟、呼吸功能锻炼、化痰药物、胸部理疗等。
术前检查及手术方法
所有入选患者在术前均进行了体格检查、常规血液学检查、心电图(ECG)、心脏彩色超声检查、下肢深静脉彩色超声检查。在呼吸功能方面的检测包括:肺通气–弥散功能检测。对于60岁以上怀疑有冠心病的患者进行冠状动脉CT检查或运动平板活动实验,必要时行冠状动脉介入检查。
术前的肿瘤分期主要依靠胸部CT、头腹部MRI、全身骨显像、纤维支气管镜,术前临床分期被认为是Ⅱ期以上的建议进行PET/CT检查。
所有患者均接受VATS或开胸肺叶切除联合肺门及纵隔淋巴结清扫,具体手术方法我们在之前的文献中已经报道[15]。
开胸手术组:采用标准的后外侧切口,长度10~20 cm,放置胸腔撑开器撑开肋间,直视下完成手术,术式为解剖性肺叶切除加系统性纵隔淋巴结清扫。
两种术式的淋巴结清扫均为系统性纵隔淋巴结清扫,而不是淋巴结取样,范围至少包括隆突下淋巴结在内的3组纵隔淋巴结和肺内淋巴结,将淋巴结连同周边脂肪组织整块切除。切除的淋巴结标本均由2位以上资深病理学医生分别进行检查、判定。
数据收集及随访
收集整理所有入选患者的人口统计数据、手术时间、术中出血、淋巴结清扫的个数,术后住院时间、术后胸管停留时间、术后肿瘤类型、分期、术后乳糜胸发生情况。
统计学分析
计量资料表达均数±标准差( ),统计学处理使用SPSS 13.0软件包进行,P<0.05认为有统计学意义。
结果
临床资料
共有5620例患者最终入选本次回顾性研究中,VATS组入选2703例,其中男性1742例(64.4%),女性961例(35.6%),平均年龄59.5±10.9岁。开胸组入选2917例,其中男性2163例(74.2%),女性754例(25.8%),平均年龄58.5±10.4岁(表1)。
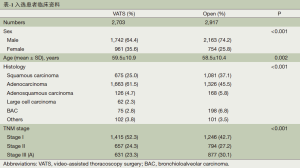
Full table
所有入选患者均接受了VATS或开胸肺叶切除术加系统淋巴结清扫术。VATS组对比开胸组:平均手术时间分别为146 min和157 min,两组之间有统计学差异(P<0.001);平均术中出血量分别为162 mL和267 mL,两组之间有统计学差异(P<0.001)(表2)。术后病理类型显示:VATS组中腺癌1663例(61.5%),鳞癌675例 (25.0%),腺鳞癌126例(4.7%),其他类型肿瘤239例(8.9%);开胸组腺癌1326例(45.5%),鳞癌1081例 (37.1%),腺鳞癌168例(5.8%),其他类型肿瘤342例(11.8%)(表1)。根据2009年国际肺癌研究协会(International Association for the Study of Lung Caneer,IASLC)的分期方法[16]对两组中所有患者的肿瘤进行病理分期及临床分级,VATS组中分别为:Ⅰ期1415例(52.3%), Ⅱ期657例(24.3%),ⅢA631例(23.3%);开胸组中分别为:Ⅰ期1246例(42.7%), Ⅱ期794例(27.2%),ⅢA877例(30.1%)(表1)。
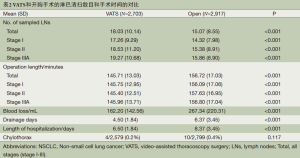
Full table
术后情况(表2)
对比两组患者的资料,术中清扫淋巴结的数量(图1):VATS组平均个数为18.03,而开胸组平均个数为15.07,两组之间有统计学差异(P<0.001);术中出血量:VATS组平均出血量为162.2 mL,而开胸组平均出血量为267.34 mL,两组之间有统计学差异(P<0.001);术后引流时间:VATS组平均时间为4.5天,而开胸组平均时间为6.37天,两组之间有统计学差异(P<0.001);术后住院时间:VATS组平均时间为6.5天,而开胸组平均时间为8.37天,两组之间有统计学差异(P<0.001);而术后发生乳糜胸的比例:VATS组为0.2%(4/2579),而开胸组为0.4%(10/2799),两组之间无统计学差异(P>0.05)。
讨论
淋巴结转移是恶性肿瘤局部及远处转移的一个重要途径,在非小细胞肺癌(NSCLC)中也不例外。其对预后的判断及治疗策略的制定有着非常重要的影响。因此,对于可手术切除的NSCLC,首选的标准手术方式为肺叶切除联合系统性淋巴结清扫,这样可以提高局部控制率、延长无病生存时间。
虽然目前系统的淋巴结清扫是否能使NSCLC患者有肿瘤学方面的获益还未证实,但是准确的淋巴结分期对确定术后是否需要辅助治疗以及预后的判断有着重要的作用。有研究表明,系统的淋巴结清扫比淋巴结取样对准确判断淋巴结分期有着明显的优势,研究者对524名术中淋巴结取样证实为阴性的Ⅰ期肺癌患者再进行系统淋巴结清扫,结果发现这些患者中有4%的患者术后石蜡病理检测证实为N2期[17]。
既往对于可切除的早中期NSCLC多采用标准的后外侧开胸手术进行肺叶切除及淋巴结清扫,但此种手术方式切口多大于10cm以上,创伤较大,患者术后恢复慢,术后并发症也较多。自20世纪90年代初以来,电视胸腔镜手术(VATS)在世界范围内得到飞速发展和迅速普及,其应用范围几乎涉及普胸外科的各个领域。与开胸手术相比,VATS手术切口小,无须切除或撑开肋骨,使得患者呼吸肌不受破坏,从而使得患者的肺功能损失较小。而且,由于切口较小而使得患者术后疼痛轻,利于排痰,减少术后肺部感染的发生率,也进一步降低了术后并发症的发生率。
VATS肺叶切除术加系统淋巴结清扫治疗早期NSCLC的安全性和有效性已经得到证实,越来越多的研究表明VATS肺叶切除术加系统淋巴结清扫作为根治性治疗手段的远期肿瘤学效果与传统开胸手术是一致的[18,19]。而且,NCCN关于非小细胞肺癌治疗指南也明确了VATS对于可切除肺癌是一种可行的选择,特别是由于身体状况等原因不能耐受标准开胸手术的患者,这意味着VATS治疗NSCLC的适应范围涵盖了目前国际公认的肺癌外科治疗的绝大部分适应证。
众所周知,淋巴结清扫是否彻底对NSCLC患者预后有重要意义,但是胸腔镜下能否进行NSCLC的系统性淋巴结清扫仍存在争论。相对于开胸手术,很多外科医生怀疑胸腔镜下淋巴结清扫的可行性及完全性。VATS进行系统淋巴结清扫目前存在最大的质疑就是担心有淋巴结残留,对此有多个研究结果证实VATS清扫淋巴结后,淋巴结的残留率都非常低。Hoksch等[20]在尸体上先行VATS下淋巴结清扫,随后再行标准后外侧切口开胸探查,结果显示肺门及纵隔未见明显残留淋巴结。Sagawa等[21]通过对29例Ⅰ期NSCLC患者先进行VATS清扫淋巴结后,再行开胸探查,证实只有2%~3%的残留。
自从VATS开始运用于淋巴结清扫,有关针对VATS对比开胸手术行系统淋巴结清扫孰优孰劣的争论就一直存在。多个针对这两种手术方式进行淋巴结清扫的回顾性或前瞻性临床研究所获得的结果不尽相同(6-14,22)。Ramos等[11]开展的回顾性研究,收集通过开胸或胸腔镜途径进行解剖性肺叶切除或肺段切除的临床Ⅰ期非小细胞肺癌患者的临床及病理数据,分析比较了两种不同手术途径清扫的纵隔淋巴结个数及纵隔淋巴结站数。结果显示:VATS清扫的淋巴结平均站数为5.1站,要多于开胸组的4.5站,两组间存在统计学差异。但是VATS清扫的淋巴结平均个数为22.6个,要远少于开胸组的25.4个,两组间存在统计学差异。Lee等[23]在分析141例VATS和115例开胸手术治疗可切除的NSCLC患者资料后,分析发现,VATS组在淋巴结清扫的数目上要少于开胸手术组(11.3 ±6.4 vs. 14.3± 8.8,P=0.001),而且在总的清扫淋巴结的站数方面也是开胸组要优于VATS组(3.1 ± 1.1 vs. 3.8 ± 1.2, P<0.001),进一步分析发现主要是与清扫纵隔淋巴结时无论是淋巴结的个数还是组数VATS组均要少于开胸组。也有一些研究证实,VATS对比开胸手术行系统淋巴结清扫在清扫的个数和站数方面无明显差别,Yang等[22]在分析对比62例可切除的NSCLC患者资料,其中VATS组和开胸手术组各为31例,结果发现两组在淋巴结清扫个数及站数上并无明显统计学差异。而在本研究中,我们通过统计分析发现,VATS组平均个数为18.03,而开胸组平均个数为15.07,两组之间有统计学差异(P<0.001),这与既往的文献报道有一定的不同。我们认为在胸腔镜下胸腔内视野几乎无死角,它可提供良好的术野,而且具有视觉放大作用,使术野得以放大,可以更加清晰地发现和暴露肺门以及纵隔各区组的淋巴结和组织,从而使得我们可以清扫出更多的纵隔淋巴结,减少淋巴结残留的发生率。
使用VATS进行肺叶切除联合系统淋巴结清扫治疗可切除的NSCLC的安全性也是大家关注的焦点。我们通过文献回顾及对比发现(表3),多数研究均发现,VATS组均比开胸手术组在术后并发症的发生率、术后胸管引流时间以及术后住院时间上有着明显的优势。本研究也证实了这一结论,我们考虑可能是由于VATS手术伤口小且可以清晰的暴露血管、淋巴结及淋巴管,这使得在进行淋巴结清扫时可以准确的切除而避免损伤淋巴结周围的小血管及淋巴管,减少了患者术后的引流液及发生乳糜胸的机会,从而使得患者术后拔管时间提前,也使得患者的术后住院时间减少。
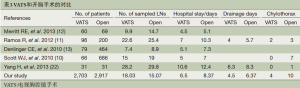
Full table
由于本研究是一个回顾性分析,还存在着许多局限性。虽然本文是目前所报道VATS对比开胸手术清扫淋巴结例数最多的一个研究,但由于数据来源于多家研究中,每个术者的胸腔镜技术水平存在一定的差别,这样也可能会引起数据的偏差。其次,本文仅仅分析了两种手术方式在清扫淋巴结个数方面的差别及术后相关并发症的相关情况,并未就对肿瘤的预后是否有差异而进行分析。因此,为了进一步了解VATS进行系统淋巴结清扫的安全性和有效性,我们还将需要进一步进行一些全面的前瞻性研究。
总之,对于可切除的NSCLC患者来说,VATS系统淋巴结清扫是安全、有效的,术后并发症也在可接受范围,而且术后恢复较传统开胸手术明显增快。
Acknowledgements
Disclosure: The authors declare no conflict of interest.
References
- Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin 2011;61:69-90. [PubMed]
- Martini N, Flehinger BJ, Nagasaki F, et al. Prognostic significance of N1 disease in carcinoma of the lung. J Thorac Cardiovasc Surg 1983;86:646-53. [PubMed]
- Roviaro G, Rebuffat C, Varoli F, et al. Videoendoscopic pulmonary lobectomy for cancer. Surg Laparosc Endosc 1992;2:244-7. [PubMed]
- McKenna R Jr. Vats lobectomy with mediastinal lymph node sampling or dissection. Chest Surg Clin N Am 1995;5:223-32. [PubMed]
- Lardinois D, De Leyn P, Van Schil P, et al. ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur J Cardiothorac Surg 2006;30:787-92. [PubMed]
- Yan TD, Black D, Bannon PG, et al. Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of video-assisted thoracic surgery lobectomy for early-stage non-small-cell lung cancer. J Clin Oncol 2009;27:2553-62. [PubMed]
- Rueth NM, Andrade RS. Is VATS lobectomy better: perioperatively, biologically and oncologically? Ann Thorac Surg 2010;89:S2107-11. [PubMed]
- Watanabe A, Mishina T, Ohori S, et al. Is video-assisted thoracoscopic surgery a feasible approach for clinical N0 and postoperatively pathological N2 non-small cell lung cancer? Eur J Cardiothorac Surg 2008;33:812-8. [PubMed]
- Kim HK, Choi YS, Kim J, et al. Outcomes of unexpected pathologic N1 and N2 disease after video-assisted thoracic surgery lobectomy for clinical stage I non-small cell lung cancer. J Thorac Cardiovasc Surg 2010;140:1288-93. [PubMed]
- Scott WJ, Allen MS, Darling G, et al. Video-assisted thoracic surgery versus open lobectomy for lung cancer: a secondary analysis of data from the American College of Surgeons Oncology Group Z0030 randomized clinical trial. J Thorac Cardiovasc Surg 2010;139:976-81; discussion 981-3. [PubMed]
- Ramos R, Girard P, Masuet C, et al. Mediastinal lymph node dissection in early-stage non-small cell lung cancer: totally thoracoscopic vs thoracotomy. Eur J Cardiothorac Surg 2012;41:1342-8; discussion 1348. [PubMed]
- Merritt RE, Hoang CD, Shrager JB. Lymph node evaluation achieved by open lobectomy compared with thoracoscopic lobectomy for N0 lung cancer. Ann Thorac Surg 2013;96:1171-7. [PubMed]
- Denlinger CE, Fernandez F, Meyers BF, et al. Lymph node evaluation in video-assisted thoracoscopic lobectomy versus lobectomy by thoracotomy. Ann Thorac Surg 2010;89:1730-5; discussion 1736.
- Flores RM, Park BJ, Dycoco J, et al. Lobectomy by video-assisted thoracic surgery (VATS) versus thoracotomy for lung cancer. J Thorac Cardiovasc Surg 2009;138:11-8. [PubMed]
- He J, Shao W, Cao C, et al. Long-term outcome and cost-effectiveness of complete versus assisted video-assisted thoracic surgery for non-small cell lung cancer. J Surg Oncol 2011;104:162-8. [PubMed]
- Rusch VW, Asamura H, Watanabe H, et al. The IASLC lung cancer staging project: a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer. J Thorac Oncol 2009;4:568-77.
- Darling GE, Allen MS, Decker PA, et al. Number of lymph nodes harvested from a mediastinal lymphadenectomy: results of the randomized, prospective American College of Surgeons Oncology Group Z0030 trial. Chest 2011;139:1124-9. [PubMed]
- Cao C, Zhu ZH, Yan TD, et al. Video-assisted thoracic surgery versus open thoracotomy for non-small-cell lung cancer: a propensity score analysis based on a multi-institutional registry. Eur J Cardiothorac Surg 2013;44:849-54. [PubMed]
- Flores RM, Park BJ, Dycoco J, et al. Lobectomy by video-assisted thoracic surgery (VATS) versus thoracotomy for lung cancer. J Thorac Cardiovasc Surg 2009;138:11-8. [PubMed]
- Hoksch B, Ablassmaler B, Walter M, et al. Radical thoracoscopic lobectomy with lymphadenectomy in a cadaver model. Can J Surg 2002;45:376-80. [PubMed]
- Sagawa M, Sato M, Sakurada A, et al. A prospective trial of systematic nodal dissection for lung cancer by video-assisted thoracic surgery: can it be perfect? Ann Thorac Surg 2002;73:900-4. [PubMed]
- Yang H, Li XD, Lai RC, et al. Complete mediastinal lymph node dissection in video-assisted thoracoscopic lobectomy versus lobectomy by thoracotomy. Thorac Cardiovasc Surg 2013;61:116-23. [PubMed]
- Lee PC, Nasar A, Port JL, et al. Long-term survival after lobectomy for non-small cell lung cancer by video-assisted thoracic surgery versus thoracotomy. Ann Thorac Surg 2013;96:951-60; discussion 960-1. [PubMed]
(译者:王炜;校对:何建行)
(本译文仅供学术交流,实际内容请以英文原文为准。)



